Ruvidar® et cancer de la vessie : données cliniques récentes et perspectives thérapeutiques
Ruvidar® (TLD-1433) : nouvelle thérapie photodynamique du cancer de la vessie réfractaire au BCG
Le cancer de la vessie non invasif de la musculeuse (NMIBC) représente une part importante des cas de cancer de la vessie, avec une proportion significative de patients qui ne répondent pas à la thérapie standard actuelle à base de BCG (Bacille Calmette-Guérin). Chez ces patients dits BCG-unresponsive, les options thérapeutiques sont limitées, et la cystectomie radicale (ablation chirurgicale de la vessie) demeure souvent la seule alternative, avec une morbidité significative. Cette situation clinique motive la recherche de thérapies innovantes permettant à la fois de préserver l’organe et d’optimiser l’efficacité anticancéreuse.
Un traitement photodynamique novateur : Ruvidar® (TLD-1433)
Ruvidar® (code TLD-1433) est une molécule photodynamique activable par lumière, développée par la société Theralase® Technologies. Lorsqu’elle est instillée dans la vessie puis exposée à une source lumineuse spécifique (laser intravésical), elle génère des espèces réactives capables de induire la destruction ciblée des cellules tumorales. Ce principe, appelé thérapie photodynamique (PDT), repose sur l’activation du photosensibilisateur par une source lumineuse externe, déclenchant une cytotoxicité dirigée.
Résultats intermédiaires de l’essai de Phase II
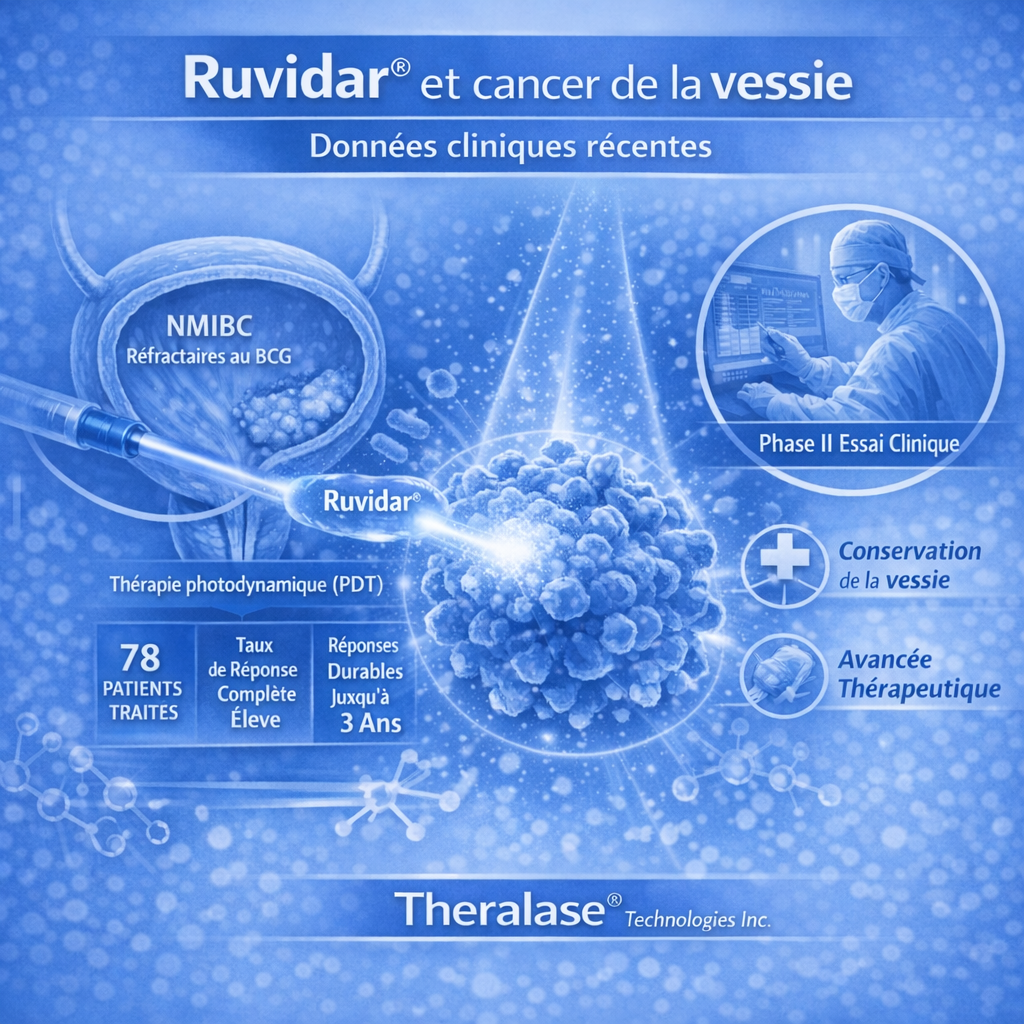
Les données cliniques intermédiaires d’un essai de Phase II sont maintenant disponibles et constituent l’une des avancées les plus attendues dans ce domaine en 2026. Ces résultats ont été sélectionnés pour une présentation interactive au congrès annuel de l’American Urological Association (AUA) prévu en mai 2026, soulignant leur importance pour la communauté urologique internationale.
Selon les informations communiquées :
78 patients atteints de NMIBC non invasif et réfractaires au BCG ont complété l’étude et ont été traités avec Ruvidar®.
Le taux de réponse complète (CR) observé est notable, avec un pourcentage élevé de patients montrant une disparition des signes de cancer à un point donné de l’évaluation.
Chez une proportion des patients ayant répondu, la durée de réponse s’est maintenue au-delà de 15 mois, et dans certains cas jusqu’à 3 ans après un seul traitement, ce qui suggère une efficacité durable chez des patients très difficiles à traiter.
Les données montrent également que le profil de sécurité est favorable, avec peu d’événements indésirables sérieux directement attribuables à la molécule ou à l’appareil d’activation.
Ces résultats dépassent les critères cliniques généralement considérés comme pertinents dans les NMIBC réfractaires au BCG, en comparaison avec les recommandations antérieures de groupes internationaux d’experts sur les taux de réponse obtenus avec d’autres thérapies intravésicales.
Implications cliniques et perspectives
L’essai TLD-1433 met en lumière plusieurs points prospectifs :
Préservation de la vessie : pour des patients qui ne répondent pas au BCG et qui seraient candidats traditionnels à une cystectomie, Ruvidar® offre une alternative potentielle non chirurgicale et focalisée, ce qui peut considérablement améliorer la qualité de vie.
Durée de réponse : la constance des réponses complètes sur des périodes prolongées (jusqu’à plusieurs années) est particulièrement encourageante et pose les bases d’un possible traitement de référence intra-vésical si la réglementation l’autorise.
Voies réglementaires : Theralase prévoit de soumettre ces données dans un processus de revue réglementaire en continu (rolling review) auprès de la FDA et de Santé Canada à partir du troisième trimestre de 2026, avec des objectifs d’approbation potentiels en 2027.
Innovations combinatoires : des essais exploratoires combinant TLD-1433 avec d’autres approches thérapeutiques (par exemple, des immunothérapies ou des vecteurs géniques) sont en cours d’évaluation, ouvrant la voie à des stratégies encore plus efficaces.
Conclusion
Les données intermédiaires présentées pour Ruvidar® (TLD-1433) constituent une avancée significative dans la prise en charge du cancer de la vessie non invasif réfractaire au BCG, un domaine où les options effectives restent rares. Les résultats suggèrent une combinaison d’efficacité durable et de tolérance favorable, ce qui en fait un candidat prometteur pour une future alternative thérapeutique. Les présentations au congrès AUA 2026 et les prochaines étapes réglementaires pourraient marquer une étape importante vers l’intégration de cette approche dans la pratique clinique standard.